COM_STUDIES_DEFAULT_PAGE_TITLE
Chemnitz
Chemnitz
Klinikum Chemnitz
0371-333-43073
Studien
AlloRelapseMM
Allogene Stammzelltransplantation im Vergleich zur konventionellen Therapie als Salvage-Therapie für Patienten mit rezidiviertem / progredientem Multiplen Myelom nach einer Erstlinientherapie (AlloRelapseMMStudy)
Organisatorische Daten:
| Prüfplancode: | |
| ISRCTN: | |
| EudraCT: | 2021-001--5-67 |
| Clinicaltrials.gov: | NCT0567319 |
| DRKS: | |
| Sponsor: | Universitätsklinikum Hamburg-Eppendorf mit Unterstützung des Gemeinsamen Bundesausschusses (G-BA) |
| Studienphase: | III |
| Status: | Rekrutierung läuft, geplant bis 6/2027 |
Ziel:
In dieser Studie wird untersucht, ob die Transplantation von gespendeten Stammzellen (allogene Stammzelltransplantation) Vorteile gegenüber der gängigen Therapie bei Patienten mit Multiplem Myelom bietet, bei denen es nach einer Transplantation von körpereigenen Stammzellen (autologe Stammzelltransplantation) als Erstlinientherapie zu einem Erkrankungsrückfall (Rezidiv) oder einem Fortschreiten der Krankheit (Progression) gekommen ist. Es wird geprüft, ob die allogene Stammzelltransplantation das Gesamtüberleben bei diesen Patienten verlängert.
Hintergrund:
Eine Behandlungsoption des Multiplen Myeloms ist die Stammzelltransplantation. Nach einer Chemotherapie, bei der die Krebszellen zerstört werden, werden körpereigene (autologe) oder gespendete körperfremde (allogene) Stammzellen übertragen. Die übertragenen Stammzellen siedeln sich dann im Knochenmark an und bilden „frische“ Blutzellen. Die Stammzelltransplantation kommt als Behandlungsoption nach der ersten Diagnose (Erstlinientherapie), aber auch bei einem Rückfall nach Vorbehandlung (jenseits der Erstlinientherapie) in Frage. Auch wenn das Multiple Myelom oft nicht endgültig heilbar ist, soll die Therapie die Lebenserwartung verlängern und die Symptome zurückdrängen. (Quelle: https://www.g-ba.de/studien/erprobung/allorelapsemmstudy-studie/)
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Diagnose Multiples Myelom,
- Rückfall (Rezidiv) oder Fortschreiten (Progress) des Multiplen Myeloms unter oder nach einer autologen Stammzelltransplantation
- Erhalt von höchstens 1 Zyklus einer sogenannten Salvage-Therapie (Rezidiv-Therapie) vor Einschluss in die Studie
Ausschlusskriterien:
- Unzureichende Organfunktion gemäß der Definition im Prüfplan
- Aktive Hepatitis B oder C oder unkontrollierte HIV-Infektion
- Andere aktive bösartige Erkrankung
- Vorherige Behandlung mit allogenen Stammzellen
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Venetoclax/Dexamethason vs. Pomalidomid/Dexamethason
Multizentrische, randomisierte, offene Studie der Phase 3 zur Bewertung der Sicherheit und Wirksamkeit von Venetoclax plus Dexamethason (VenDex) im Vergleich zu Pomalidomid plus Dexamethason (PomDex) bei Teilnehmern mit t(11;14)-positivem oder refraktärem Multiplem Myelom (MM).
Organisatorische Daten:
| Prüfplancode: | M13-494 |
| ISRCTN: | |
| EudraCT: | 2017-003838-88 |
| Clinicaltrials.gov: | NCT03539744 |
| DRKS: | |
| Sponsor: | AbbVie |
| Studienphase: | Phase 3 |
| Status: | Rekrutierung läuft, geplant bis Juli 2025 |
Ziel:
In dieser Studie wird das progressionsfreie Überleben von Patienten mit t(11;14)-positivem MM untersucht, die entweder Venetoclax in Kombination mit Dexamethason oder Pomalidomid in Kombination mit Dexamethason erhalten.
Hintergrund:
Venetoclax ist ein Bcl-2-Hemmer, der zur Behandlung der chronisch lymphatischen Leukämie bereits zugelassen ist. Es zählt chemisch gesehen zu den kleinen Moleküle, auch "small molecules" genannt.
Venetoclax hemmt selektiv das Protein Bcl-2, das bei verschiedenen Krebsarten, einschließlich multiplem Myelom, vermehrt vorkommt. Bcl-2 unterdrückt den programmierten Zelltod (Apoptose) der Tumorzellen. Venetoclax hingegen blockiert Bcl-2 im Zellinneren und führt so zum programmierten Zelltod der Tumorzellen. Dadurch wird auch die Wirksamkeit herkömmlicher Chemotherapeutika verbessert.
Zu den Nebenwirkungen von Venetoclax zählen Übelkeit, Durchfall, Atemwegsinfekte, Müdigkeit, Blutarmut (Anämie), Neutropenie, Thrombozytopenie, Unfruchtbarkeit(bei Männern).
Durch den raschen Zerfall der Tumorzellen kann es zu einem Tumorlyse-Syndrom (TLS) kommen.
Bemerkungen zur Durchführung:
Teilnehmer, die nach dem Zufallsprinzip der Behandlung mit Venetoclax plus Dexamethason (VenDex) zugeteilt werden (Arm 1), erhalten Ventoclax einmal täglich als Tablette plus Dexamethason oral einmal wöchentlich in jedem 28-Tage-Zyklus.
Teilnehmer, die der Behandlung mit Pomalidomid plus Dexamethason (PomDex) zugeteilt werden (Arm 2), erhalten Pomalidomid einmal täglich als Kapsel an Tag 1 bis 21 plus Dexamethason oral einmal wöchentlich in jedem 28-Tage-Zyklus.
Teilnehmer, die Arm 2 (PomDex) zugeteilt werden, können sich nach einem dokumentiertem Fortschreiten der Krankheit gemäß den Kriterien der International Myeloma Working Group (IMWG) für eine VenDex-Therapie entscheiden, sofern sie dafür geeignet sind.
Einschlusskriterien:
- Dokumentierte Diagnose eines Multiplen Myeloms (MM) auf der Grundlage von IMWG-Standardkriterien.
- Messbare Krankheit bei der Voruntersuchung (Screening) gemäß Protokoll.
- Mindestens 2 vorherige Therapielinien, wie im Protokoll beschrieben.
- Dokumentierter Krankheitsverlauf an oder innerhalb von 60 Tagen nach Abschluss der letzten Therapie.
Ausschlusskriterien:
- Behandlung mit Venetoclax oder einem anderen B-Zell-Lymphom-(BCL-)2-Inhibitor oder Pomalidomid in der Vorgeschichte.
- Anderer aktive maligne Erkrankungen (Malignome), einschließlich myelodysplastischer Syndrome (MDS), innerhalb der letzten 3 Jahre (im Protokoll sind Ausnahmen beschriebene).
- Nachweis einer andauernden Graft-versus-Host Erkrankung (GvHD) bei vorheriger Stammzelltransplantation (SCT).
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt
Teclistamab, Daratumumab, Lenalidomid,Dexamethason +/- Bortezomib
Phase-2-Studie zur Bewertung der Sicherheit und Wirksamkeit von Teclistamab in Kombination mit Daratumumab, Lenalidomid und Dexamethason mit und ohne Bortezomib als Induktionstherapie und Teclistamab in Kombination mit Daratumumab und Lenalidomid als Erhaltungstherapie bei transplantationsgeeigneten Patienten mit neu diagnostiziertem Multiplem Myelom
Organisatorische Daten:
| Prüfplancode: | GMMG-HD10, DSMM-XX, 64007957MMY2003, MajesTEC-5 |
| ISRCTN: | |
| EudraCT: | |
| Clinicaltrials.gov: | NCT05695508 |
| DRKS: | |
| Sponsor: | Universitätsklinikum Heidelberg in Zusammenarbeit mit Janssen |
| Studienphase: | Phase 3 |
| Status: | Rekrutierung läuft, geplant bis Mai 2026 |
Hintergrund:
Teclistamab ist ein bispezifischer Antikörper, der an das B-Zell-Reifungsantigen (BCMA), ein Protein auf der Oberfläche von Myelomzellen, bindet und gegen CD3-Rezeptoren auf der Oberfläche von T-Zellen gerichtet ist. Teclistamab wurde im August 2022 in der EU als Monotherapie zur Behandlung des fortgeschrittenen Multiplen Myeloms zugelassen und wird jetzt bei weiteren Indikationen geprüft.
In dieser Studie bei Patienten mit neu diagnostiziertem Multiplem Myelom, die für eine Transplantation geeignet sind, werden die Sicherheit, Verträglichkeit und Wirksamkeit einer Fünffach-Kombination in der Induktionstherapie geprüft: Teclistamab (Tec) in Kombination mit Daratumumab (Dara), Lenalidomid (R), Bortezomib (V) und Dexamethason (d).
Durchführung
Das Studiendesign gliedert sich in drei Studienarme:
Patienten in Arm A und B erhalten eine Induktionstherapie mit Tec-Dara-Rd (Arm A) oder Tec-Dara-VRd (Arm B). Es folgen eine Hochdosis-Chemotherapie und eine autologe Stammzelltransplantation gemäß Therapiestandard sowie eine Erhaltungstherapie mit Tec-Dara-R.
Patienten in Arm C erhalten eine Induktionstherapie gemäß Therapiestandard gefolgt von einer Hochdosis-Chemotherapie und einer autologen Stammzelltransplantation sowie gegebenenfalls einer Konsolidierungstherapie. Im Anschluss daran folgt eine Erhaltungstherapie mit Tec-Dara-R.
Die Behandlungsdauer der Induktionsphase beträgt 6 Zyklen (à 28 Tage). Im Anschluss daran folgen eine Hochdosis-Chemotherapie und autologe Stammzelltransplantation . Danach beginnt die Erhaltungsphase der Studie unter Tec-Dara-R über 18 Zyklen.
Studienarm C beginnt mit dem Screening nach abgeschlossener Hochdosis-Chemotherapieplus autologer Stammzelltransplantation. Die Behandlung erfolgt genauso wie in Arm A und B mit Tec-Dara-R als Erhaltungstherapie für 18 Zyklen.
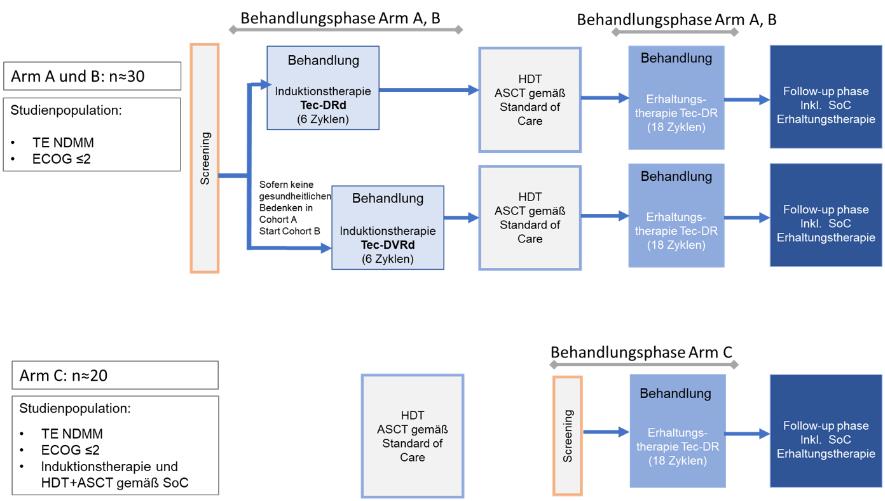
Abb. Studiendesign, mit freundlicher Genehmigung des Universitätsklinikums Heidelberg, Prof. Raab
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Neu diagnostiziertes Multiples Myelom gemäß den Diagnosekriterien der International Myeloma Working Group (IMWG) und Erhalt einer Induktionstherapie mit oder ohne Konsolidierung
- Ein ECOG-Performance-Status-Score (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) von 0, 1 oder 2 beim Screening und unmittelbar vor Beginn der Verabreichung der Studienbehandlung
- Messbare Erkrankung während der Screening-Phase, gemäß der Definition im Protokoll
Ausschlußkriterien
- Beteiligung des ZNS oder klinische Anzeichen für eine Beteiligung der Hirnhäute
- Schlaganfall oder Krampfanfall innerhalb von 6 Monaten vor Studienbeginn
- Transplantation in der Krankengeschichte, die eine immunsuppressive Behandlung erforderte
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Induktionstherapie mit Lenalidomid, Bortezomib und Dexamethason und entweder intravenösem oder subkutanem Isatuximab bei Patienten mit neu diagnostiziertem Multiplem Myelom, die für eine Hochdosis-Chemotherapie mit nachfolgender autologer Stammzelltransplantation geeignet sind
Organisatorische Daten:
| Prüfplancode: | GMMG-HD 8 / DSMM XIX |
| ISRCTN: | |
| EudraCT: | 2022-000996-38 |
| Clinicaltrials.gov: | NCT05804032 |
| DRKS: | |
| Sponsor: | Universitätsklinikum Heidelberg DSMM, Sanofi und KKS-Netzwerk |
| Studienphase: | |
| Status: | Rekrutierung geplant bis Juni 2025 |
Ziel:
In dieser Studie für Patienten mit zuvor unbehandeltem Multiplem Myelom soll die Wirksamkeit der Induktionstherapie mit Isatuximab in Kombination mit Lenalidomid/Bortezomib/Dexamethason (RVd) bei Gabe von Isatuximab unter die Haut (subkutan) gegenüber einer Gabe in die Vene (intravenös) untersucht werden.
Durchführung:
Randomisierung: Die Patienten werden vor der Induktionstherapie nach dem Zufallsverfahren (randomisiert) einem von 2 Studienarmen (A oder B) zugeordnet.
- Patienten in Arm A erhalten 3 Zyklen des monoklonalen Antikörpers Isatuximab intravenös in Kombination mit dem RVd-Schema (Lenalidomid, Bortezomib, Dexamethason). Jeder Zyklus hat eine Dauer von 42 Tagen.
- Patienten in Arm B erhalten 3 Zyklen Isatuximab subkutan in Kombination mit RVd.
Nach der Induktionstherapie erhalten die Patienten eine Standard-Intensivierung (in der Regel eine Mobilisierungstherapie auf Cyclophosphamid-Basis, Stammzellenentnahme und hochdosiertes Melphalan, gefolgt von einer autologen Stammzelltransplantation
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Bestätigte Diagnose eines neu diagnostizierten behandlungsbedürftigen Multiplen Myeloms gemäß den überarbeiteten Diagnosekriterien der International Myeloma Working Group (IMWG))
- Der Patient ist für eine Hochdosis-Chemotherapie und eine autologe Stammzelltransplantation geeignet
- Messbare Krankheitsaktivität (gemäß der Definition im Prüfplan)
- Alter 18 bis 70 Jahre bei Studieneinschluss
Ausschlußkriterien:
- Bekannte Überempfindlichkeit (oder Kontraindikation) gegen einen der Bestandteile der Studientherapie
- Systemische Amyloid-Leichtketten-Amyloidose (außer lokalisierte Amyloid-Leichtketten -Amyloidose, die auf die Haut oder das Knochenmark beschränkt ist)
- Plasmazell-Leukämie
- Vorherige Chemo- oder Strahlentherapie in den letzten 5 Jahren (außer lokaler Strahlentherapie bei lokalem Fortschreiten des Myeloms)
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Studie zu Elranatamab als Monotherapie und Elranatamab + Daratumumab im Vergleich zu Daratumumab + Pomalidomid + Dexamethason bei Teilnehmern mit rezidiviertem/refraktärem Multiplem Myelom
Organisatorische Daten:
| Prüfplancode: | C1071005, MagnetisMM-5 |
| ISRCTN: | |
| EudraCT: | 2021-000044-22 |
| Clinicaltrials.gov: | NCT05020236 |
| DRKS: | |
| Sponsor: | Pfizer |
| Studienphase: | Phase 3 |
| Status: | Rekrutierung läuft, geplant bis Okt. 2024 |
Ziel:
Mit dieser Studie soll untersucht werden, ob der bispezifische BCMA/CD3-Antikörper Elranatamab allein und/oder in Kombination mit dem monoklonalen Anti-CD38-Antikörper Daratumumab für Patienten mit Multiplem Myelom einen größeren Nutzen bringt als eine Kombinationstherapie aus Daratumumab, Pomalidomid und Dexamethason.
Hintergrund:
Der bispezifische BCMA/CD3-Antikörper Elranatamab (PF-06863135) zeigte bei Patienten mit rezidiviertem/refraktärem Multiplem Myelom eine vielversprechende vorläufige Wirksamkeit und Verträglichkeit.
Daten aus der Phase-1-Studie MagnetisMM-1 (NCT03269136), die auf der ASCO-Jahrestagung 2021 vorgestellt wurden, zeigten, dass Elranatamab in Dosen von bis zu 1000 µg/kg ein überschaubares Sicherheitsprofil ohne dosislimitierende Toxizitäten aufweist.
Darüber hinaus erzielte der Wirkstoff bei Dosierungen von 215 µg/kg und höher eine Gesamtansprechrate (ORR) von 70 % und eine vollständige Ansprechrate (CR)/stringente CR von 30 %. Bei der empfohlenen Phase-2-Dosis von 1000 µg/kg erzielte der Wirkstoff eine ORR von 83,3 %. Bemerkenswert ist, dass drei von vier in die Studie aufgenommenen Patienten, die zuvor mit einer BCMA-gerichteten Therapie behandelt worden waren, ein Ansprechen erzielten.
Durchführung:
In die Studie werden Patienten mit Multiplem Myelom aufgenommen, die zuvor mit Lenalidomid und einem Proteasom-Inhibitor behandelt wurden.
In Teil 1 der Studie wird die Sicherheit und Wirksamkeit verschiedener Dosen von Elranatamab in Kombination mit Daratumumab untersucht.
Die Teilnehmer an Teil 2 der Studie werden nach dem Zufallsprinzip einer von drei Behandlungsgruppen zugeteilt.
- Teilnehmer in Gruppe 1 erhalten Elranatamab allein als Injektion unter die Haut.
- Teilnehmer der Gruppe 2 erhalten Elranatamab und Daratumumab als Injektion unter die Haut.
- Teilnehmer der Gruppe 3 erhalten die Standardtherapie Daratumumab als Injektion unter die Haut sowie Pomalidomid und Dexamethason zur Einnahme.
In Teil 2 wird die Sicherheit und Aktivität von (1) Elranatamab allein im Vergleich zu Daratumumab, Pomalidomid und Dexamethason und (2) Elranatamab plus Daratumumab im Vergleich zu Daratumumab, Pomalidomid und Dexamethason verglichen. Die Teilnehmer beider Studienteile erhalten die Studienbehandlung so lange, bis ihre Krankheit fortschreitet, unannehmbare Nebenwirkungen auftreten oder sie sich entscheiden, nicht weiter an der Studie teilzunehmen.
Einschlusskriterien:
- Diagnose eines Multiplen Myeloms gemäß den von der International Myeloma Working Group (IMWG) aufgestellten Diagnosekriterien )
- Messbare Erkrankung, definiert durch mindestens 1 der folgenden Punkte:
- M-Protein im Serum > 0,5 g/dl durch SPEP
- M-Protein-Ausscheidung im Urin > 200 mg/24 Stunden mittels UPEP
- Freie Immunglobulin-Leichtketten (FLC) im Serum ≥ 10 mg/dl (≥ 100 mg/l) UND abnormes Verhältnis der Immunglobuline Kappa-zu-Lambda-FLC-im Serum
- Vorherige Therapie gegen multiples Myelom, einschließlich Behandlung mit Lenalidomid und einem Proteasom-Inhibitor.
- ECOG Performance Status (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) von 0, 1 oder 2.
Ausschlusskriterien:
- Schwelendes Multiples Myelom
- Aktive Plasmazellleukämie
- Amyloidose
- POEMS-Syndrom
- Stammzelltransplantation innerhalb von 12 Wochen vor der Aufnahme in die Studie
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt
Studie mit Elranatamab im Vergleich zu Lenalidomid bei Patienten mit neu diagnostiziertem Multiplem Myelom nach Transplantation
Organisatorische Daten:
| Prüfplancode: | C1071005, MagnetisMM-7 |
| ISRCTN: | |
| EudraCT: | 2021-006052-14 |
| Clinicaltrials.gov: | NCT05317416 |
| DRKS: | |
| Sponsor: | Pfizer |
| Studienphase: | Phase 3 |
| Status: | Rekrutierung läuft, geplant bis Juni 2027 |
Randomisierte, 2-armige Phase-3-Studie mit Elranatamab (PF-06863135) im Vergleich zu Lenalidomid bei Patienten mit neu diagnostiziertem Multiplem Myelom, die nach einer autologen Stammzelltransplantation eine minimale Resterkrankung aufweisen.
Ziel:
Mit dieser Studie soll untersucht werden, ob eine Elranatamab-Monotherapie im Vergleich zu einer Lenalidomid-Monotherapie Teilnehmern mit neu diagnostiziertem Multiplem Myelom einen klinischen Nutzen bietet, bei denen nach einer autologen Stammzelltransplantation noch eine minimale Resterkrankung nachweisbar ist.
Hintergrund:
Der bispezifische BCMA/CD3-Antikörper Elranatamab (PF-06863135) zeigte bei Patienten mit rezidiviertem/refraktärem Multiplem Myelom eine vielversprechende vorläufige Wirksamkeit und Verträglichkeit.
Daten aus der Phase-1-Studie MagnetisMM-1 (NCT03269136), die auf der ASCO-Jahrestagung 2021 vorgestellt wurden, zeigten, dass Elranatamab in Dosen von bis zu 1000 µg/kg ein überschaubares Sicherheitsprofil ohne dosislimitierende Toxizitäten aufweist.
Darüber hinaus erzielte der Wirkstoff bei Dosierungen von 215 µg/kg und höher eine Gesamtansprechrate (ORR) von 70 % und eine vollständige Ansprechrate (CR)/stringente CR von 30 %. Bei der empfohlenen Phase-2-Dosis von 1000 µg/kg erzielte der Wirkstoff eine ORR von 83,3 %. Bemerkenswert ist, dass drei von vier in die Studie aufgenommenen Patienten, die zuvor mit einer BCMA-gerichteten Therapie behandelt worden waren, ein Ansprechen erzielten.
Durchführung:
Die Teilnehmer an der Studie werden nach dem Zufallsprinzip einer von zwei Behandlungsgruppen zuteilt.
- Teilnehmer in Gruppe 1 erhalten Elrantamab als Injektion unter die Haut in der Studienklinik. Nach den anfangs an den gegenwärtigen Zustand des Patienten angepassten Dosen (sogenannte Step-up-Dosen) erhalten die Teilnehmer dann eine Dosis Elrantamab pro Woche. Nach 6 Monaten wird die Häufigkeit der Klinikbesuche für die Verabreichung der Injektionen auf jede zweite Woche reduziert.
- Teilnehmer in Gruppe 2 erhalten Lenalidomid oral einmal täglich zu Hause.
Die Teilnahme an der Studie dauert etwa fünf Jahre.
Ein und Ausschlusskriterien:
Einschlusskriterien:
-
Diagnose eines Multiplen Myeloms gemäß den von der International Myeloma Working Group (IMWG) aufgestellten Diagnosekriterien
-
Vorgeschichte einer Induktionstherapie für neu diagnostiziertes MM, gefolgt von einer Hochdosistherapie und einer autologen Stammzelltransplantation (ASZT). Die Randomisierung muss innerhalb von 120 Tagen nach der ASZT erfolgen. Bei Teilnehmern, die nach der ASZT eine Konsolidierungstherapie erhalten, muss die Randomisierung innerhalb von 60 Tagen nach der Konsolidierung und innerhalb von 6 Monaten nach der ASZT erfolgen.
-
Partielles Ansprechen oder besser nach den IMWG-Kriterien zum Zeitpunkt der RandomisierungNachweis einer minimalen Resterkrankung (MRD-positiv, ≥ 10-5) beim Screening.
-
ECOG Performance Status (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) von 0 oder 1.
Ausschlusskriterien:
-
Plasmazell-Leukämie
-
POEMS-Syndrom
-
Amyloidose, Waldenström-Makrogobulinämie
-
Bekannte aktive Beteiligung des ZNS oder klinische Anzeichen einer Beteiligung der Hirnhäute (Meningen)
-
Vorherige MM-Erhaltungstherapie
-
Vorherige Behandlung mit einer BCMA-Therapie
-
Jede andere aktive bösartige Erkrankung innerhalb von 3 Jahren vor der Aufnahme in die Studie, mit Ausnahme von adäquat behandeltem Basalzell- oder Plattenepithelkarzinom der Haut oder Karzinom in situ (z. B. bei der Diagnose) oder vor der Transplantation.
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt
Zusätzliche Information
Studienübersicht des Klinikum Chemnitz

