COM_STUDIES_DEFAULT_PAGE_TITLE
München
München
Hämato-Onkologische Gemeinschaftspraxis Pasing
089 - 82 99 660
LMU - Medizinische Klinik und Poliklinik III der Universität München, Medizinische Klinik und Poliklinik III, Campus-Großhadern
089-4400-0
Studien
Cartitude 5Eine Studie zur Untersuchung von Bortezomib, Lenalidomid und Dexamethason (VRd) gefolgt von Ciltacabtagen-Autoleucel (Cilta-Cel, JNJ-68284528) im Vergleich zu VRd, gefolgt von Lenalidomid und Dexamethason (Rd) bei Teilnehmern mit neu diagnostiziertem Multiplem Myelom (MM), für die eine autologe Stammzelltransplantation (SZT) als Ersttherapie nicht vorgesehen ist (CARTITUDE-5)
Organisatorische Daten:
| Prüfplancode: | CARTITUDE-5 (68284528MMY3004, CR109015) |
| ISRCTN: | |
| EudraCT: | 2021-001242-35 |
| Clinicaltrials.gov: | NCT04923893 |
| DRKS: | |
| Sponsor: | Janssen |
| Studienphase: | III |
| Status: | Rekrutierung geplant bis Juni 2026 |
Ziel:
Die Studie soll untersuchen, ob die Behandlung mit VRd-Induktion gefolgt von einer einmaligen Verabreichung von Cilta-Cel im Vergleich zur Induktion mit Bortezomib, Lenalidomid und Dexamethason (VRd) und anschließender Rd-Erhaltung bei Teilnehmern mit neu diagnostiziertem MM das progressionsfreie Überleben signifikant verbessert.
Hintergrund:
Chimäre Antigenrezeptor-T-Zellen (CAR-T-Zellen) sind ein innovativer Ansatz zur Ausrottung von Krebszellen, bei dem die Kraft des patienteneigenen Immunsystems genutzt wird.
Bei Ciltacabtage-Autoleucel (Cilta-Cel; JNJ-68284528) handelt es sich um eine autologe CAR-T-Therapie, die auf das B-Zell-Reifungsantigen (BCMA) abzielt. Dieses Molekül kommt auf der Oberfläche von reifen B-Lymphozyten und bösartigen Plasmazellen vor. Indem Cilta-Cel gezielt gegen BCMA gerichtet ist, kann es Krebszellen vernichten, während gesunde Zellen unversehrt bleiben.
Durchführung:
Im Rahmen der Studie werden Teilnehmer mit neu diagnostiziertem MM untersucht, bei denen eine autologe Stammzelltransplantation (ASZT) als Ersttherapie nicht vorgesehen ist. Diese Studie wird in 4 Phasen durchgeführt: Screening (bis zu 28 Tage), Behandlung vor der Randomisierung, Behandlung und Nachbeobachtung.
Während der Studie werden verschiedene Untersuchungen zur Wirksamkeit und Sicherheit durchgeführt. Die Sicherheitsdaten werden in regelmäßigen Abständen von einem unabhängigen Datenüberwachungsausschuss überprüft. Die Dauer der Studie beträgt etwa 12 Jahre und 5 Monate.
Ablauf der Studie:

Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Dokumentierte Diagnose eines Multiplen Myeloms (MM) gemäß den Diagnosekriterien der International Myeloma Working Group (IMWG)
- Messbare Erkrankung zum Zeitpunkt des Screenings, wie im Prüfplan definiert
- ECOG Performance Status (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) von 0 oder 1.
- Patient kommt nicht für eine Hochdosis-Chemotherapie mit autologer Stammzelltransplantation (ASCT) infrage
Ausschlußkriterien:
- Gebrechlichkeitsindex ≥ 2 gemäß dem Myeloma Geriatric Assessment Score (Index zur Abstufung der Gebrechlichkeit von Patienten von 0 bis 5, http://www.myelomafrailtyscorecalculator.net/)
- Periphere Neuropathie oder neuropathischer Schmerz Grad 2 oder höher (gemäß der Definition des National Cancer Institute-Common Terminology Criteria for Adverse Events (NCI-CTCAE) Version 5)
- Bekannte aktive oder frühere Beteiligung des zentralen Nervensystems (ZNS) oder klinische Anzeichen einer meningealen Beteiligung des MM
- Schlaganfall oder Krampfanfall innerhalb von 6 Monaten nach Unterzeichnung der Einwilligungserklärung
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Belantamab-Mafodotin
Bewertung der Wirksamkeit und Sicherheit von Belantamab-Mafodotin, Bortezomib und Dexamethason gegenüber Daratumumab, Bortezomib und Dexamethason bei Teilnehmern mit rezidiviertem/refraktärem Multiplen Myelom
Organisatorische Daten:
| Prüfplancode: | 207503 |
| ISRCTN: | |
| EudraCT: | 2018-003993-29 |
| Clinicaltrials.gov: | NCT04246047 |
| DRKS: | |
| Sponsor: | GlaxoSmithKline |
| Studienphase: | III |
| Status: | Rekrutierung geplant bis Juni/2026 |
Kurzbeschreibung:
Hierbei handelt es sich um eine randomisierte, offene Phase-3-Studie zur Untersuchung der Sicherheit und Wirksamkeit von Belantamab-Mafodotin in Kombination mit Bortezomib/Dexamethason (Arm A) gegenüber Daratumumab in Kombination mit Bortezomib/Dexamethason (Arm B) bei Teilnehmern mit rezidivierendem multiplem Myelom..
Hintergrund:
Die amerikanische Arzneimittelbehörde FDA hat Belantamab-Mafodotin-blmf (GSK2857916; Blenrep) für die Behandlung von Patienten mit rezidiviertem oder refraktärem Multiplen Myelom zugelassen, die zuvor mit mindestens 4 Therapien behandelt wurden, darunter ein immunmodulatorisches Mittel, ein Proteasom-Inhibitor und ein Anti-CD38-Antikörper. Dies ist weltweit die erste Anti-BCMA-Behandlung, die bei dieser Patientenpopulation verfügbar ist.
Belantamab-Mafodotin ist gegen das B-Zell-Reifungsantigen (BCMA) gerichtet, das eine wichtige Rolle für das Überleben von Plasmazellen spielt und auf Zellen des Multiplen Myeloms exprimiert wird. Das Antikörper-Wirkstoff-Konjugat Belantamab-Mafodotin bindet an BCMA auf Myelom-Zelloberflächen, wodurch der Zellzyklus angehalten und eine antikörperabhängige zelluläre Zytotoxizität induziert wird.
Normalerweise fördert BCMA das Überleben von Plasmazellen durch Signalübertragung von zwei bekannten Liganden. Dieser Signalweg hat sich als wichtig für das Wachstum und Überleben von Myelomzellen erwiesen.
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Bestätigte Diagnose eines Multiplen Myeloms (MM) gemäß IMWG-Kriterien
- Vorbehandlung des MM mit mindestens einer Therapielinie und dokumentierte Krankheitsprogression während oder nach der letzten Therapie.
- ECOG Performance Status (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) von 0 bis 2
- Muss mindestens 1 Aspekt einer messbaren Erkrankung aufweisen, wie folgt definiert:
- Urin-M-Protein-Ausscheidung > 200 mg pro 24 Stunden, oder
- Serum-M-Protein-Konzentration > 0,5 g/dl, oder
- Freie Leichtketten im Serum (FLC): beteiligter FLC-Spiegel > 10 mg/dl (> 100 mg/L) und ein abnormes Verhältnis der freien Leichtketten im Serum (< 0,26 oder > 1,65).
- Alle Nebenwirkungen, die infolge durch Vorbehandlungen hervorgerufen wurden, müssen zum Zeitpunkt der Rekrutierung < Grad 1 sein, mit Ausnahme von Alopezie.
Ausschlußkriterien:
- Unverträglichkeit gegenüber Daratumumab.
- Kein bzw. kein hinreichendes Ansprechen (therapierefraktär) gegenüber Daratumumab oder einer anderen Anti-CD38-Therapie (definiert als fortschreitende Erkrankung während der Behandlung mit einer Anti-CD38-Therapie oder innerhalb von 60 Tagen nach Abschluss dieser Behandlung).
- Unverträglichkeit gegenüber Bortezomib oder kein bzw. kein hinreichendes Ansprechen (therapierefraktär) gegenüber Bortezomib (definiert als fortschreitende Erkrankung während der Behandlung mit einem Bortezomib-haltigen Schema von 1,3 mg/m2 zweimal wöchentlich oder innerhalb von 60 Tagen nach Abschluss dieser Behandlung). Hinweis: Patienten mit fortschreitender Erkrankung während der Behandlung mit einem wöchentlichen Bortezomib-Schema dürfen teilnehmen.
- Anhaltende periphere Neuropathie von Grad 2 oder höher oder neuropathische Schmerzen.
- Vorherige Behandlung mit einer Anti-B-Zellreifungsantigen- (Anti-BCMA-) Therapie.
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Zusätzliche Information
Myelomsprechstunde
jeweils Dienstags, 08:00 - 16:00 Uhr
Tel: 089 - 4400-73041
MRI - III. Medizinische Klinik und Poliklinik der Technischen Universität Rechts der Isar
Prof. Dr. Florian Bassermann, 089 - 4140-5834
Studien
CC-92480Ein neuer Cereblon E3 Ligase Modulator
Eine Studie zur Bestimmung der empfohlenen Dosis und des Regimes und zur Bewertung der Sicherheit und vorläufigen Wirksamkeit von CC-92480 in Kombination mit Standardbehandlungen bei Patienten mit rezidiviertem oder refraktärem Multiplen Myelom (RRMM) und neu diagnostiziertem Multiplen Myelom (NDMM)
Organisatorische Daten:
| Prüfplancode: |
CC-92480-mm-02 |
| UTMS | U1111-1233-5619 |
| EudraCT: | 2018-004767-31 |
| Clinicaltrials.gov: | NCT03989414 |
| DRKS: | |
| Sponsor: | Celgene |
| Studienphase: | Phase 1/2 |
| Status: | Rekrutierung läuft, geplant bis Januar 2025 |
Hintergrund:
CC-92480 ist ein sogenannter CRBN-Modulator [Cereblon-(CRBN-)E3-Ligase-Modulator (CELMoD)]. Dieser neuartige Modulator hat vielfältige Wirkungen und wirkt unter anderem stark immunmodulierend. Der Wirkstoff führt zu einem schnellen, tiefen und anhaltenden Zerfall von Ikaros und Aiolos – zwei Faktoren, die zum Überleben der Myelomzellen beitragen.
Durchführung:
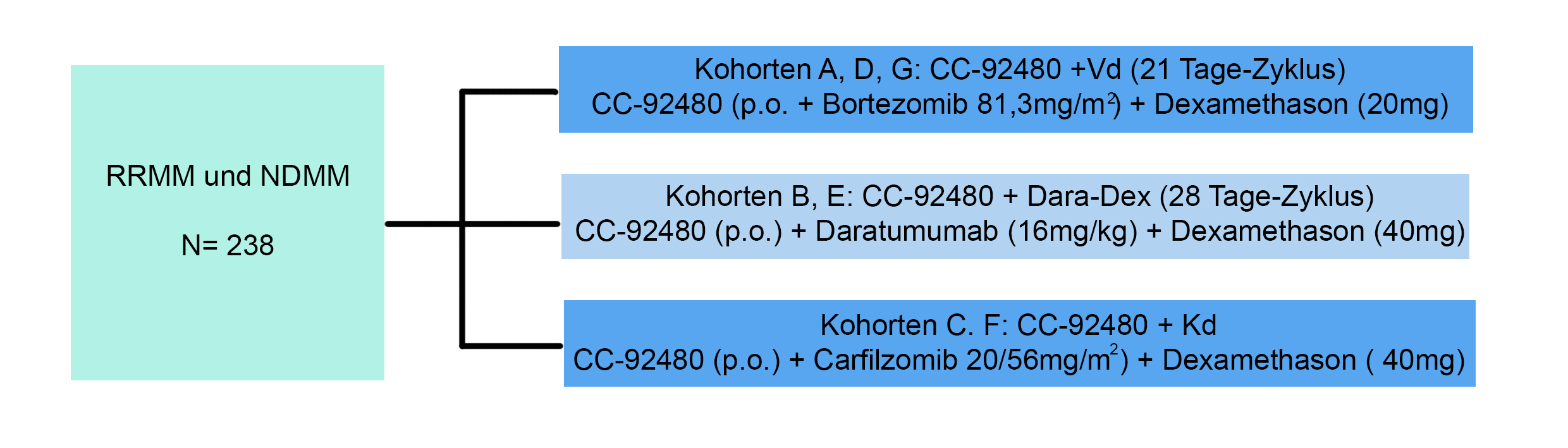
Die Studie wird randomisiert ausgeführt und die Patienten in 3 Gruppen eingeteilt, die neben dem CC-92480 unterschiedliche Zweier-Kombinationen enthalten, die gegeneinander getestet werden. Die Kohorten haben unterschiedliche Einschlusskriterien.
Ein und Ausschlusskriterien:
Einschlusskriterien:
- Alter ≥ 18 Jahre alt und ECOG (Index zur Abstufung der Lebensqualität von Patienten mit Krebserkrankungen) mit 0, 1 oder 2 Punkten.
- Patienten mit rezidiviertem oder refraktäremMultiplen Myelom müssen eine messbare Krankheit haben und ihr Krankheitsverlauf während oder nach ihrer letzten Myelomtherapie muss dokumentiert sein.
- Bei neu diagnostizierten Patienten muss die Diagnose eines zuvor unbehandelten symptomatischen Multiplen Myeloms dokumentiert sein.
- Frauen im gebärfähigen Alter und männliche Patienten müssen mit dem Schwangerschaftsverhütungsplan einverstanden sein.
Ausschlusskriterien:
- Signifikante medizinische Erkrankung, auffällige Laborwerte oder eine psychiatrische Krankheit, die an der Teilnahme an der Studie hindert.
- Patient ist nicht in der Lage oder nicht bereit, sich der laut Prüfplan vorgeschriebenen Prophylaxe einer Thromboembolie zu unterziehen.
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt
Studie zu CC-93269, einem BCMA x CD3 T-Zell-aktivierendem Antikörper, bei Patienten mit rezidivierendem und refraktärem multiplem Myelom
Organisatorische Daten:
| Prüfplancode: |
CC-93269 |
| ISRCTN: | |
| EudraCT: | |
| Clinicaltrials.gov: | NCT03486067 |
| DRKS: | |
| Sponsor: | Celgene |
| Studienphase: | Phase 1 |
| Status: | Rekrutierung läuft, geplant bis Juli 2027 |
Kurzbeschreibung:
In der offenen Phase-1-Studie CC-93269-MM-001 wird CC-93269 erstmals beim Menschen – und zwar bei Patienten mit rezidiviertem und refraktärem multiplem Myelom – untersucht.
Hintergrund:
CC-93269 ist ein sogenannter bispezifischer T-Zell Antikörper (BiTE Antikörper= Bi-specific T-cell engagers). Diese Antikörper verknüpfen das auf Myelomzellen vorhandene B-Zell-Reifungsantigen (BCMA) mit T-Zellen und führen so zu einer T-Zell vermittelten Zerstörung von Myelomzellen. BCMA, ein Mitglied der Tumornekrosefaktor-Rezeptor-Superfamilie, das auf malignen Plasmazellen vermehrt vertreten ist, spielt eine Schlüsselrolle bei der Förderung des Überlebens von Plasmazellen.
Durchführung:
Die Studie besteht aus zwei Teilen: einem Dosissteigerungsteil (Teil A) und einem Erweiterungsteil (Teil B). In Teil A wird die Sicherheit und Verträglichkeit von intravenös verabreichtem CC-93269 in steigenden Dosen bewertet, um die höchste verträgliche Dosis und die nicht verträgliche Dosis sowohl der ersten als auch der nachfolgenden Gaben von CC-93269 zu bestimmen. In Teil B wird die Sicherheit und Wirksamkeit von CC-93269, das den Teilnehmern in ausgewählten Studiengruppen in der höchsten verträglichen oder einer niedrigeren Dosis verabreicht wird, weiter untersucht, um die empfohlene Dosis für die Phase 2 zu bestimmen. Alle Behandlungen werden in 28-Tage-Zyklen bis zu 2 Jahre lang verabreicht, bis die Erkrankung fortschreitet, nicht vertretbare Nebenwirkungen auftreten oder der Teilnehmer/Prüfer sich zum Abbruch der Teilnahme entscheiden.
Einschlusskriterien:
- Multiples Myelom (MM) in der Vorgeschichte mit rezidivierter und refraktärer Erkrankung und erfolglose Behandlung mit, Unverträglichkeit gegenüber oder fehlende Eignung für verfügbare(n) Therapien
-
Messbare Krankheit gemäß Beurteilung durch ein Zentrallabor
-
Einwilligung zum Krankenhausaufenthalt zur Überwachung und zur Entnahme von peripheren Blutproben
-
Einwilligung zu Knochenmarkpunktionen und/oder Gewebeproben im Rahmen der Studie
Ausschlusskriterien:
- Vorbehandlung mit einer in der Erforschung befindlichen Therapie gegen das B-Zell-Reifungsantigen (BCMA)
- Multiples Myelom mit symptomatischer Beteiligung des zentralen Nervensystems
- Nicht-sezernierendes multiples Myelom, Plasmazellleukämie, Morbus Waldenström (Makroglobulinämie), POEMS-Syndrom (Polyneuropathie, Organomegalie, Endokrinopathie, monoklonales Protein und Hautveränderungen) oder Amyloidose
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt
Induktionstherapie mit Lenalidomid, Bortezomib und Dexamethason und entweder intravenösem oder subkutanem Isatuximab bei Patienten mit neu diagnostiziertem Multiplem Myelom, die für eine Hochdosis-Chemotherapie mit nachfolgender autologer Stammzelltransplantation geeignet sind
Organisatorische Daten:
| Prüfplancode: | GMMG-HD 8 / DSMM XIX |
| ISRCTN: | |
| EudraCT: | 2022-000996-38 |
| Clinicaltrials.gov: | NCT05804032 |
| DRKS: | |
| Sponsor: | Universitätsklinikum Heidelberg DSMM, Sanofi und KKS-Netzwerk |
| Studienphase: | |
| Status: | Rekrutierung geplant bis Juni 2025 |
Ziel:
In dieser Studie für Patienten mit zuvor unbehandeltem Multiplem Myelom soll die Wirksamkeit der Induktionstherapie mit Isatuximab in Kombination mit Lenalidomid/Bortezomib/Dexamethason (RVd) bei Gabe von Isatuximab unter die Haut (subkutan) gegenüber einer Gabe in die Vene (intravenös) untersucht werden.
Durchführung:
Randomisierung: Die Patienten werden vor der Induktionstherapie nach dem Zufallsverfahren (randomisiert) einem von 2 Studienarmen (A oder B) zugeordnet.
- Patienten in Arm A erhalten 3 Zyklen des monoklonalen Antikörpers Isatuximab intravenös in Kombination mit dem RVd-Schema (Lenalidomid, Bortezomib, Dexamethason). Jeder Zyklus hat eine Dauer von 42 Tagen.
- Patienten in Arm B erhalten 3 Zyklen Isatuximab subkutan in Kombination mit RVd.
Nach der Induktionstherapie erhalten die Patienten eine Standard-Intensivierung (in der Regel eine Mobilisierungstherapie auf Cyclophosphamid-Basis, Stammzellenentnahme und hochdosiertes Melphalan, gefolgt von einer autologen Stammzelltransplantation
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Bestätigte Diagnose eines neu diagnostizierten behandlungsbedürftigen Multiplen Myeloms gemäß den überarbeiteten Diagnosekriterien der International Myeloma Working Group (IMWG))
- Der Patient ist für eine Hochdosis-Chemotherapie und eine autologe Stammzelltransplantation geeignet
- Messbare Krankheitsaktivität (gemäß der Definition im Prüfplan)
- Alter 18 bis 70 Jahre bei Studieneinschluss
Ausschlußkriterien:
- Bekannte Überempfindlichkeit (oder Kontraindikation) gegen einen der Bestandteile der Studientherapie
- Systemische Amyloid-Leichtketten-Amyloidose (außer lokalisierte Amyloid-Leichtketten -Amyloidose, die auf die Haut oder das Knochenmark beschränkt ist)
- Plasmazell-Leukämie
- Vorherige Chemo- oder Strahlentherapie in den letzten 5 Jahren (außer lokaler Strahlentherapie bei lokalem Fortschreiten des Myeloms)
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Zusätzliche Information
Myelomsprechstunde
Terminvereinbarung unter Tel. 089 - 4140-4107
Onkologische Praxis Elisenhof
(089) 45 22 56-0
Onkologische Schwerpunktpraxis Dr. med. Walther
089-554417
Rotkreuzklinikum München Abteilung für Innere Medizin III – Hämatologie und Onkologie
(089) 1303-0
Studien
GMMG-HD8/DSMM-XIX
Induktionstherapie mit Lenalidomid, Bortezomib und Dexamethason und entweder intravenösem oder subkutanem Isatuximab bei Patienten mit neu diagnostiziertem Multiplem Myelom, die für eine Hochdosis-Chemotherapie mit nachfolgender autologer Stammzelltransplantation geeignet sind
Organisatorische Daten:
| Prüfplancode: | GMMG-HD 8 / DSMM XIX |
| ISRCTN: | |
| EudraCT: | 2022-000996-38 |
| Clinicaltrials.gov: | NCT05804032 |
| DRKS: | |
| Sponsor: | Universitätsklinikum Heidelberg DSMM, Sanofi und KKS-Netzwerk |
| Studienphase: | |
| Status: | Rekrutierung geplant bis Juni 2025 |
Ziel:
In dieser Studie für Patienten mit zuvor unbehandeltem Multiplem Myelom soll die Wirksamkeit der Induktionstherapie mit Isatuximab in Kombination mit Lenalidomid/Bortezomib/Dexamethason (RVd) bei Gabe von Isatuximab unter die Haut (subkutan) gegenüber einer Gabe in die Vene (intravenös) untersucht werden.
Durchführung:
Randomisierung: Die Patienten werden vor der Induktionstherapie nach dem Zufallsverfahren (randomisiert) einem von 2 Studienarmen (A oder B) zugeordnet.
- Patienten in Arm A erhalten 3 Zyklen des monoklonalen Antikörpers Isatuximab intravenös in Kombination mit dem RVd-Schema (Lenalidomid, Bortezomib, Dexamethason). Jeder Zyklus hat eine Dauer von 42 Tagen.
- Patienten in Arm B erhalten 3 Zyklen Isatuximab subkutan in Kombination mit RVd.
Nach der Induktionstherapie erhalten die Patienten eine Standard-Intensivierung (in der Regel eine Mobilisierungstherapie auf Cyclophosphamid-Basis, Stammzellenentnahme und hochdosiertes Melphalan, gefolgt von einer autologen Stammzelltransplantation
Ein- und Ausschlusskriterien (Auswahl):
Einschlusskriterien:
- Bestätigte Diagnose eines neu diagnostizierten behandlungsbedürftigen Multiplen Myeloms gemäß den überarbeiteten Diagnosekriterien der International Myeloma Working Group (IMWG))
- Der Patient ist für eine Hochdosis-Chemotherapie und eine autologe Stammzelltransplantation geeignet
- Messbare Krankheitsaktivität (gemäß der Definition im Prüfplan)
- Alter 18 bis 70 Jahre bei Studieneinschluss
Ausschlußkriterien:
- Bekannte Überempfindlichkeit (oder Kontraindikation) gegen einen der Bestandteile der Studientherapie
- Systemische Amyloid-Leichtketten-Amyloidose (außer lokalisierte Amyloid-Leichtketten -Amyloidose, die auf die Haut oder das Knochenmark beschränkt ist)
- Plasmazell-Leukämie
- Vorherige Chemo- oder Strahlentherapie in den letzten 5 Jahren (außer lokaler Strahlentherapie bei lokalem Fortschreiten des Myeloms)
Alle weiteren Kriterien besprechen Sie bitte mit Ihrem behandelnden Arzt.
Zusätzliche Information
Myelomsprechstunden:
Prof. Dr. Marcus Hentrich, Terminvereinbarung unter (089) 1303-4372 (Sekretariat)
PD Dr. med. Peter Bojko, Terminvereinbarung unter (089)1303-4372
Städtisches Klinikum München Schwabing, Klinik für Hämatologie, Onkologie, Immunologie, Palliativmedizin, Infektiologie und Tropenmedizin
(089) 3068-2228
Studien
DSMM XIVPhase III-Studie zum Vergleich einer Induktionstherapie aus Lenalidomid, Adriamycin, Dexamethason (RAD) mit Lenalidomid, Bortezomib, Dexamethason (VRD) gefolgt von einer am Ansprechen ausgerichteten Stammzelltransplantation bei Patienten mit neu diagnostiziertem multiplen Myelom.
| Prüfplancode: | DSMM XIV |
| ISRCTN: | |
| EudraCT: | 2009-016616-21 |
| Clincaltrials.gov: | NCT01685814 |
| DRKS: | 0003967 |
Allgemeine Informationen
In der Studie werden die Raten der kompletten Remission zweier Induktionsschemata (ein neues Medikament [RAD] gegen zwei neue Medikamente [VRD]) bei Patienten mit neu diagnostiziertem multiplem Myelom verglichen und das progressionsfreie Überleben nach einer Konsolidierungsbehandlung bestimmt.
Die Patienten sollten Über 18 Jahre und unter 65 Jahre alt sein, bisher ohne eine systemische Myelomtherapie sein und für eine Stammzelltransplantation in Frage kommen.
Die weiteren Ein- und Ausschlusskriterien kann man hier nachlesen.
Zusätzliche Information
Ärztliche Leitung
Prof. Dr. Clemens Wendtner
Prof. Dr. Christian Straka
Städtisches Krankenhaus München, Klinikum Harlaching, Abt. für Hämatologie, Onkologie und Palliativmedizin
(089) 6210-2731
Zusätzliche Information
Ärztliche Leitung:
Prof. Dr. Meinolf Karthaus

